«Фосфатная метка» оказалась важной для регуляции белка, мутация которого вызывает лейкоз
Ученые показали, что ядрышковый белок нуклеофозмин (NPM1), нарушения в котором могут вызвать развитие лейкемии и других видов рака, взаимодействует со своим регуляторным белком только при фосфорилировании нуклеофозмина
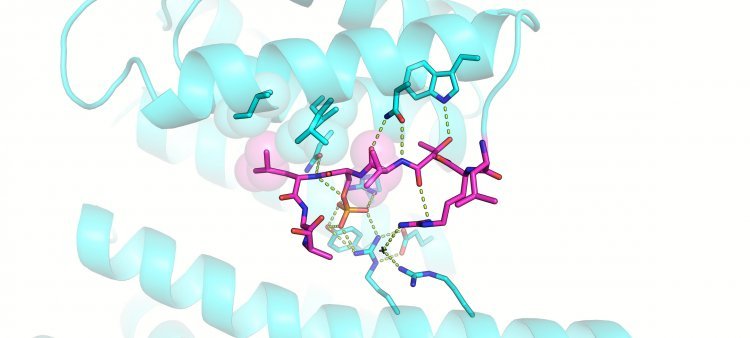
Ученые из ФИЦ Биотехнологии РАН показали, что ядрышковый белок нуклеофозмин (NPM1), нарушения в котором могут вызвать развитие лейкемии и других видов рака, взаимодействует со своим регуляторным белком только при фосфорилировании нуклеофозмина (включении в его состав «фосфатной метки»). Она присоединяется к NPM1 благодаря специальному ферменту и кардинально меняет силу связывания этого белка с его партнером-регулятором. Получение пространственной структуры комплекса 14-3-3 с ключевым фрагментом нуклеофозмина, содержащим «фосфатную метку», открывает возможности для дальнейшей разработки новых препаратов от некоторых видов рака. Результаты исследования, поддержанного грантом Российского научного фонда и Министерством науки и высшего образования Российской Федерации, опубликованы в журнале Biochemical and Biophysical Research Communications. Исследование проводилось при поддержке национального проекта «Наука и университеты».
Белки — это биологические полимеры, выполняющие разнообразные функции в нашем организме. Например, нуклеофозмин (NPM1) регулирует жизненный цикл клеток, участвует в синтезе других белков, а также влияет на выживание и развитие нейронов человека. При этом мутации нуклеофозмина могут приводить к острым миелоидным лейкемиям (рак крови), и ученые рассматривают его в качестве важного опухолевого маркера и потенциальной мишени для создания лекарственных препаратов.
Работа NPM1, его укладка и расположение в клетке контролируются с помощью различных четко скоординированных механизмов, одним из которых является взаимодействие со специальными регуляторными белками из семейства 14-3-3. Для того чтобы повлиять на работу NPM1, белки 14-3-3 взаимодействуют с ним в области, которая может содержать «фосфатную метку». Более ранние исследования показали, что она необходима для взаимодействия с 14-3-3, однако структура комплекса между двумя этими белками оставалась неизвестной.
Ученые из Федерального исследовательского центра «Фундаментальные основы биотехнологии» РАН (Москва) с коллегами из Университета штата Орегон (США) исследовали молекулярный комплекс, который образуется при взаимодействии NPM1 с белком 14-3-3. Авторы клонировали гены этих двух человеческих белков в клетки кишечной палочки. Бактерии наработали нужные молекулы, и далее авторы выделили интересующие белки и определили структуру их комплекса. Для этого NPM1 был соединен с белком 14-3-3 с помощью искусственной гибкой перемычки, что позволило сблизить те участки белков, которые должны взаимодействовать.
Полученная с помощью кристаллографии структура комплекса белка 14-3-3 с функционально значимым фрагментом нуклеофозмина подтверждает перспективность и универсальность разработанного авторами ранее подхода, основанного на создании гибридных комплексов 14-3-3-партнер, для исследования различных комплексов с участием белков 14-3-3.
Информация и фото предоставлены пресс-службой ФИЦ Биотехнологии РАН





